Các kim loại kiểm thổ tạo nên nhóm 2a trong bảng tuần hoàn. Khám phá định nghĩa về kim loại kiềm thổ, đặc tính của chúng và cách chúng ảnh hưởng đến sức khỏe con người.
Các kim loại kiềm thổ là gì?
Cuối năm 1950, các nhà khoa học bắt đầu một dự án có tên là Plowshare với mục tiêu sử dụng bom hạt nhân để tạo ra các nguyên tố mới, khai thác quặng, xây dựng kênh đào, đường xá và tạo ra điện.
Người ta đã hy vọng có thể mở rộng kênh đào Panama bằng một vụ nổ hạt nhân.
Để chuẩn bị cho dự án này các thử nghiệm được tiến hành khắp nước Mỹ. Dự án dần chết đi do một phát hiện rằng strontium phóng xạ được tìm thấy ở nồng độ đặc biệt cao ở nơi tiến hành thí nghiệm.
Stonti phóng xạ này có thể gây ung thư ở mức độ cao nên công chúng đã ngăn chặn dự án này.
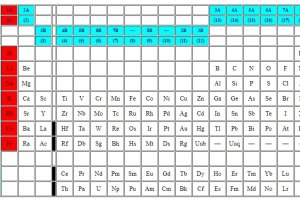
Stonti là nguyên tố thứ sáu thuộc về kim loại kiềm thổ hay nhón 2a. Các nhóm là các cột dọc trên bảng tuần hoàn và nhóm 2a ở bên trái. Đôi khi, nhóm 2a được thể hiện bằng chứ số La Mã IIA.
Bảng tuần hoàn
.jpg)
Các kim loại kiềm thổ bao gồm berili (Be), magie (Mg), canxi (Ca), stronti (Sr), bari (Ba) và rađi (Ra). Các phần tử được nhóm lại với nhau vì có chung các thuộc tính. Bây giờ bạn có thể đang nghĩ, có một nguyên tố phóng xạ có đặc tính gần giống với canxi trong sữa của chúng ta.
Tính chất hóa học, vật lý của kim loại kiềm thổ
Đúng vậy, canxi trong sữa và stronti phóng xạ thật sự có rất nhiều điểm chung. Chúng có cùng số electron hóa trị hoặc các electron lớp ngoài cùng mang lại nhiều tính chất của chúng. Các kim loại kiềm thổ thuộc kim loại nhóm 2A và chúng có hai electron hóa trị.
Vì vậy, canxi và stronti đều có hai electron hóa trị. Nếu bạn định ngừng uống sữa thì đừng lo. Không phải tất cả stronti đều có tính phóng xạ.
Một phần do hai electron hóa trị đó, các kim loại kiềm thổ rất dễ phản ứng. Điều này có nghĩa chúng muốn liên kết với các nguyên tố khác. Mặc dù chúng không phản ứng mạnh như người làng giêng bên trái, kim loại kiềm, nhưng chúng vẫn phản ứng khá tốt.
Vì chúng rất dễ phản ứng nên bạn không thể tìm thấy kim loại kiềm thổ ở dạng nguyên chất trong tự nhiên.
Ví dụ, canxi kết hợp với cacbon và oxy tạo thành canxi cacbonat. Được coi là hợp chất phổ biến nhất trên trái đất. Nó không chỉ chiếm 7% vỏ trái đất mà cọn tạo nên san hô, vỏ trúng, vỏ sò.

Phản ứng này đúng với các kim loại kiềm thổ khác. Magie kết hợp với oxy, tạo thành oxit magie, là hợp chất phổ biến thứ hai trong lớp vỏ trái đất.
Trên thực tế, tất cả các kim loại kiềm thổ đều có thể tìm thấy trong vỏ trái đất. Một trong những nhóm khác, kim loại kiềm, nghe rất giống nhau. Để phân biệt hãy nhớ rằng kim loại kiềm thổ có rất nhiều trong thổ (đất).
Hãy quay lại với các electron hóa trị của nó. Các kim loại kiềm thổ rất muốn thoát khỏi hai electron hóa trị của chúng. Điều này đạt được bằng cách đưa chúng đi cho các nguyên tố khác.
Các electron có điện tích âm và khi các kim loại kiềm thổ cho chúng đi. Chúng trở thành các cation hoặc nguyên tử có điện tích dương cụ thể là +2.
Tạo thành cation +2 là một tính chất là tất cả các kim loại kiềm thổ đều có chung.
Là một cation +2 giúp xác định kim loại kiềm thổ có thể liên kết với ai – giống như các nguyên tố beri kết hợp với nhau để tạo ra ngọc lục bảo, hoặc tất cả các nguyên tố canxi kết hợp với nhau để tạo ra vỏ sò.
Dưới đây là một số thông tin thêm về kim loại kiềm thổ. Khi nhóm này được thêm vào nước, dung dịch của nó có tính kiềm. Một từ khác của kiềm là bazo, hoặc một chất có độ PH lớn hơn bảy. Một số thứ cơ bản mà bạn có thể quen thuộc là thuốc tẩy và chất tẩy rửa khác.
Các nguyên tố trong nhóm này có màu bạc, dễ uốn, khá mềm khi ở dạng nguyên chất.
Hầu hết các kim loại kiềm thổ hình thành liên kết ion trong đó các electron hóa trị được chuyển từ nguyên tử này sang nguyên tử khác. Nhưng beri mà magie cũng có thể hình thành liên kết cộng hóa trị, trong đó các electron được chia sẻ giữa các nguyên tử.
Kim loại kiềm thổ và sức khỏe của bạn

Bạn biết rằng canxi trong sữa rất tốt cho xương, nhưng còn các kim loại kiềm thổ khác thì sao? Magie cũng có chức năng quan trọng trong cơ thể, như điều hòa huyết áp và tổng hợp DNA.
Nhưng không phải tất cả kim loại kiềm thổ đều là chất dinh dưỡng quan trọng. Stontium phóng xạ từ bụi phóng xạ hạt nhân.
Một nghiên cứu chỉ ra những người đàn ông chết vì ung thư ở tuổi trung niên tại St. Louis có lượng stronti phóng xạ cao gấp hai lần bình thường trong răng của họ.
Một thành phần phóng xạ khác là radium, chất này từng được sử dụng làm sơn phát sáng trong bóng tối và dụng cụ máy bay. Nhưng ngày nay nó ít được sử dụng vì nguy cơ gây ung thư.
Berili và bari đều có nhiều mục đích thương mại nhưng có thể gây hại nếu hít phải hoặc nuốt phải khi chúng ở một số dạng nhất định. Ví dụ, berili có thể gây tổn thương phổi và bari có thể gây ra nhiều vấn đề, từ sưng não đến tổn thương thận.
Tóm tắt kiếm thức kim loại kiềm thổ
Một số kim loại kiềm thổ chảy trong cơ thể của bạn. Trong khi những kim loại khác khiến bạn bị bệnh nặng. Chúng tạo nên sai nguyên tố nhóm 2a bên trái của bảng tuần hoàn.
Tóm tắt một số thuộc tính của nhóm 2a:
- Chúng có 2 electron hóa trị, chúng có thể mất đi tạo thành cation +2.
- Đa số hình thành liên kết ion.
- Chúng có tính phản ứng mạnh nên không tìm thấy ở dạng nguyên chất trong tự nhiên.
- Chúng tìm thấy nhiều trong vỏ trái đất và tạo thành dung dịch kiềm khi thêm vào nước. Cả hai tính chất này tạo nên tên – kim loại kiềm thổ.
- Chúng mềm, dễ uốn và có màu bạc.
Khi đọc xong bài này hy vọng bạn có thể:
- Xác định vị trí nhóm 2a trên bảng tuần hoàn.
- Liệt kê các phần tử có trong nhóm 2a.
- Nêu tính chất chung của kim loại kiềm thổ.
Bài viết liên quan:



Any comments?